Eine klinische Studie ist in der evidenzbasierten Medizin und klinischen Forschung eine Form der Erhebung. Sie wird mit Patienten oder gesunden Probanden durchgeführt und ist eine Voraussetzung für die behördliche Arzneimittelzulassung.
Ziel ist es, Medikamente, bestimmte Behandlungsformen, medizinische Interventionen oder Medizinprodukte auf ihre Wirksamkeit und Sicherheit zu überprüfen. Klinische Studien werden durchgeführt, um wissenschaftliche Fragestellungen zu beantworten und die medizinische Behandlung zu verbessern.
Der erste Einsatz einer erfolgsversprechenden medizinischen Behandlung am Menschen sollte daher eine klinische Studie mit dem Ziel sein, Wirksamkeit und Verträglichkeit neuer Therapien zu testen. Eine solche kann allerdings erst dann stattfinden, wenn ausreichend Daten für eine sichere Durchführung vorhanden sind und ein positives Votum der betroffenen Ethikkommission vorliegt. Um äußerliche Störeinflüsse zu minimieren, werden derartige Studien in einem kontrollierten Umfeld durchgeführt.
Die Ataxia Global Initiative (AGI) ist eine weltweite Forschungsplattform, deren Ziel es ist, die klinische Entwicklung von Therapien für Ataxien zu erleichtern.
Im Einzelnen fördert die AGI
die gemeinsame Nutzung von Daten und Biomaterialien,
trägt zur Definition weltweit anerkannter gemeinsamer Standards für klinische Forschung und interventionelle Studien bei,
stellt Informationen zur Verfügung, die für die Vorbereitung und Durchführung klinischer Studien relevant sind,
organisiert und veranstaltet internationale Tagungen und Konferenzen, um die Fachwelt in wichtigen Fragen auf den neuesten Stand zu bringen und zu informieren,
bietet Dienstleistungen an, die die Vorbereitung von Studien unterstützen,
bietet Schulungs- und Ausbildungsprogramme an und
Informationen über klinische Forschung für Menschen mit Ataxie und die Öffentlichkeit bereitzustellen.
Mit dem Förderbetrag von über 4,5 Mio. EUR wird ein virtuelles Institut mit sieben europäischen Universitäten und sieben Partnern aus der Industrie und gemeinnützigen Organisationen geschaffen. Mit den Mitteln werden 15 Doktoranden unterstützt, die in den nächsten vier Jahren in dem Konsortium arbeiten werden.
Das Ausbildungsnetz konzentriert sich auf die Rolle eines bisher übersehenen Teils des Gehirns, des Kleinhirns, und seine Beteiligung an der Steuerung von Emotionen. Das Kleinhirn (lateinisch für kleines Gehirn) enthält mehr Nervenzellen als alle anderen Gehirnregionen zusammen.
Neben der Entdeckungsforschung wird der Schwerpunkt des CEN auf der Ausbildung einer neuen Generation von Wissenschaftlern liegen, die über Expertenwissen sowohl in der Grundlagenforschung als auch in der klinischen Forschung verfügen.
Darüber hinaus werden die Doktoranden Erfahrungen aus erster Hand in privaten Unternehmen, Nichtregierungsorganisationen, Rehabilitationskliniken und nationalen und internationalen Patientenselbsthilfegruppen sammeln, um ihren Horizont zu erweitern
Was sind die Ziele des EFACTS-Patientenregisters?
Ein wichtiger Meilenstein für EFACTS ist die Rekrutierung von mindestens 600 Patienten aus der europäischen Friedreich-Ataxie-Population bis 2014. Die Ziele des EFACTS-Patientenregisters sind:
Klinische Daten über ein breites Spektrum von Personen zu erheben
klinische Merkmale mit genetischen Faktoren ("genetische Modifikatoren"), Daten aus der Untersuchung von Biomaterialien (Blut und Urin) und Bildgebungsdaten in Beziehung zu setzen
Bereitstellung von Biomaterialien für Forschungsstudien
Entwicklung neuer Maßnahmen zur Verfolgung des Krankheitsverlaufs sowie Verbesserung bestehender Instrumente
schnelle Rekrutierung von Patienten für künftige Therapiestudien zu ermöglichen
Angebot neuer therapeutischer Interventionen für Patienten
Die Europäische Gesellschaft für Molekulare Bildgebung (ESMI) vertritt die wissenschaftliche Gemeinschaft, die sich mit der multidisziplinären molekularen Bildgebung beschäftigt. Dazu gehören Grundlagenforschung, präklinische, translationale und klinische Forschung zu Bildgebungstechnologien, Methoden, Biomarkern und Sonden, Modellierung und Datenanalyse.
Im Mittelpunkt des Auftrags steht die Schaffung einer kollaborativen Gemeinschaft, die neue Ideen zur Abbildung biologischer Prozesse verfolgt. Die ESMI ist bestrebt, dieses Wissen aus experimentellen Bildgebungsstudien in die Umsetzung von diagnostischen und therapeutischen Strategien zu übertragen.
Übergeordnetes Ziel: Die EMA soll Vorschläge für das Design klinischer Studien, optimierte Ergebnismessungen und innovative Analysen dazu erhalten, die so informativ wie möglich sind, um robuste Beweise/Schlussfolgerungen mit möglichst kleinen Populationen zu ermöglichen. Anwendungsfall werden autosomal-rezessive zerebellare Ataxien (ARCAs) sein, aber wir werden auch auf Datensätze für spinozerebellare Ataxien (SCAs) zurückgreifen, wenn dies möglich ist.
Ein Vertreter der EuroAtaxia wird die Perspektive der Ataxie-Patienten einbringen, um Informationen zu liefern:
1. die Entwicklung eines klinisch aussagekräftigen Ergebnismaßes (WP2), einschließlich der Perspektiven auf aussagekräftige Items, sinnvolle Veränderungen usw.
2. die Entwicklung des Studiendesigns und der Studienmodellierung (WP3 und 4), einschließlich der Perspektive, welche Arten von Studien für Ataxie-Patienten akzeptabel wären, welcher Grad an Behandlungseffektgrößen akzeptabel wäre und welche Randomisierungsverfahren akzeptabel wären oder nicht.
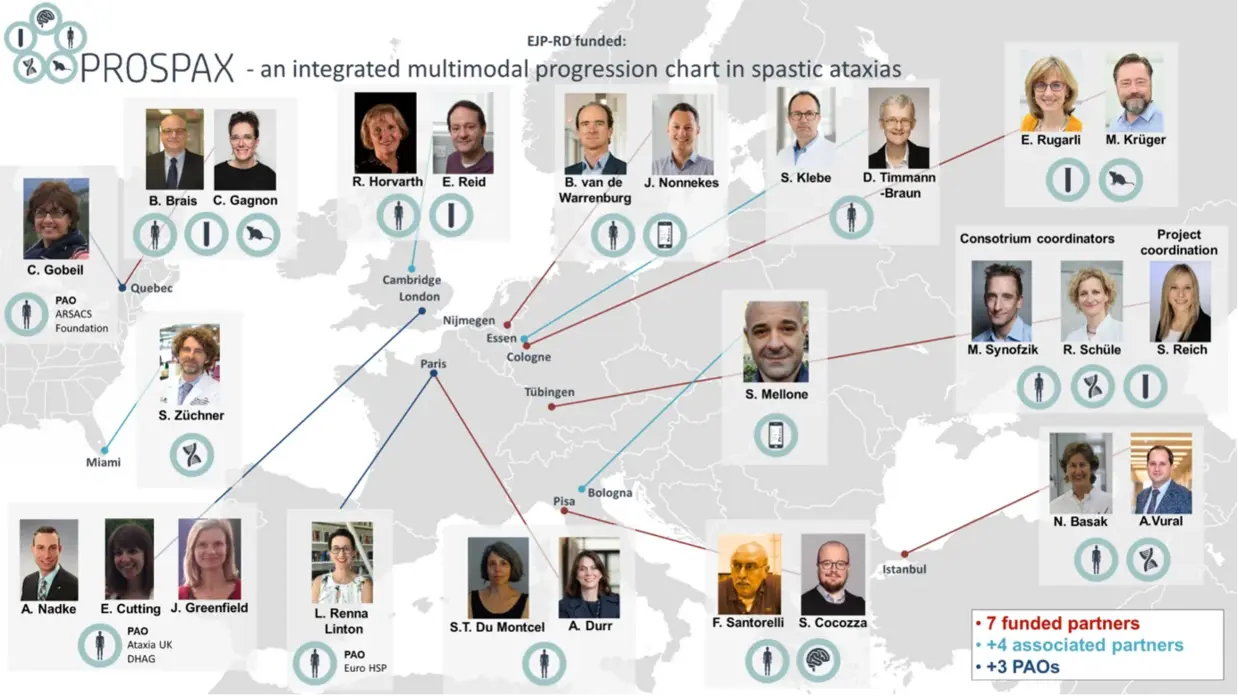
Was ist PROSPAX?
Das Projekt PROSPAX (PROgression chart of SPAstic ataXias) ist ein Gemeinschaftsprojekt von Neurologen an mehreren Standorten in Europa und Kanada. Ziel des PROSPAX-Projekts ist es, ein besseres Verständnis dafür zu gewinnen, wie spastische Ataxien im Laufe der Zeit fortschreiten. Dieses ehrgeizige Projekt umfasst die Bildgebung des Gehirns, die Untersuchung von Markern des Krankheitsverlaufs im Blut und die Entwicklung von Tiermodellen.
Das PROSPAX-Projekt konzentriert sich auf ARSACS und SPG7 und wird Forschungsmethoden entwickeln, die in Zukunft auch auf andere spastische Ataxien angewendet werden können. Die PROSPAX-Erhebungen zielen darauf ab, Informationen von Menschen mit allen Formen von Ataxie/HSP zu sammeln, um ein Bewertungsinstrument für diese Erkrankungen zu entwickeln.
Bislang werden bei Ataxien (SCA‘s) Volumenmessungen von Hirnstamm und Kleinhirn via 7T-MRT Studien genutzt, die allerdings die für klinische Biomarker erforderliche Spezifität und Sensitivität nicht erfüllen.
Die Ultrahochfeld-MRT (UHF-MRT) hat ein enormes Potenzial zur Erkennung und Verfolgung struktureller und chemischer Veränderungen des Gehirns mit sehr hoher Genauigkeit, die mit 3T nicht erreicht werden kann.
Daher ist das Ziel des Verbundes die Etablierung quantitativer UHF-MRI-Biomarker für SCAs mit einem hohen Potenzial für die Früherkennung von Krankheitsmanifestationen und die Überwachung des Krankheitsverlaufs. Das Vorhaben des Koordinators Tony Stöcker (01ED2109A) wird dazu ultraschnelle Bildgebungsverfahren etablieren und spezielle Akquisitions- und Auswerteverfahren für molekulare Bildgebungsmethoden auf die Anwendung im Kleinhirn anpassen.
Das Vorhaben von Thomas Klockgether (01ED2109B) wird unter Verwendung der neuen UHF-MRT-Protokolle eine multizentrische Studie mit Patientinnen und Patienten sowie gesunden Kontrollen durchführen.
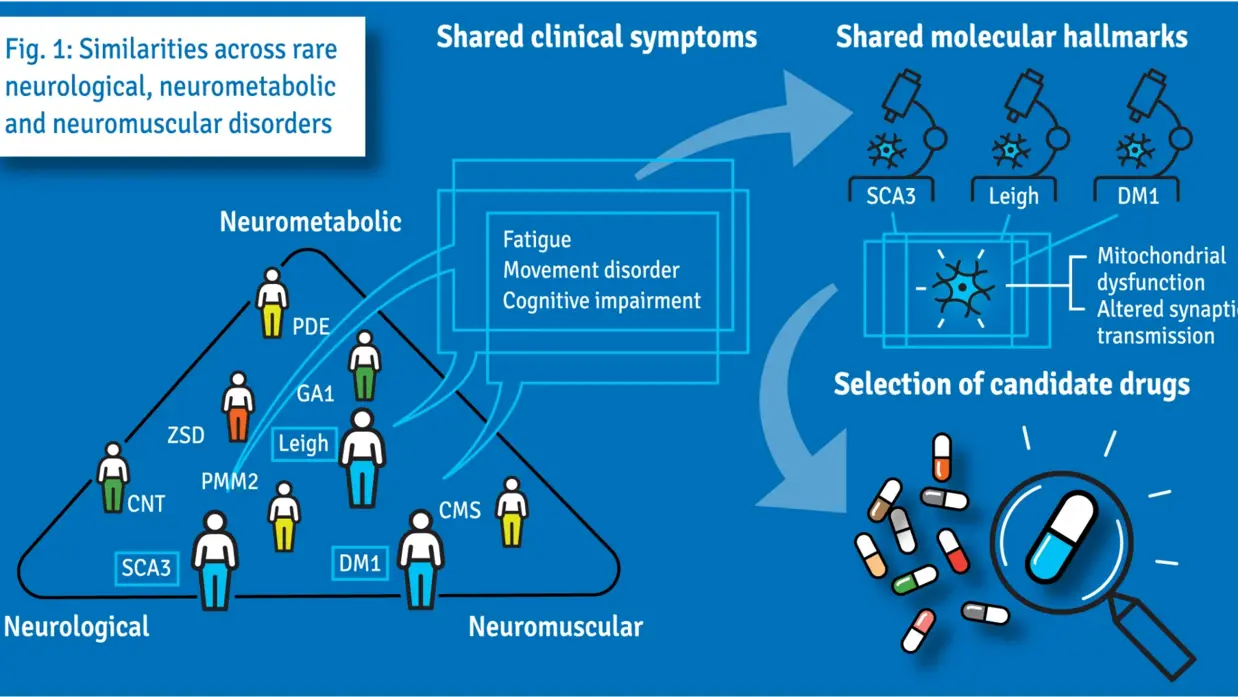
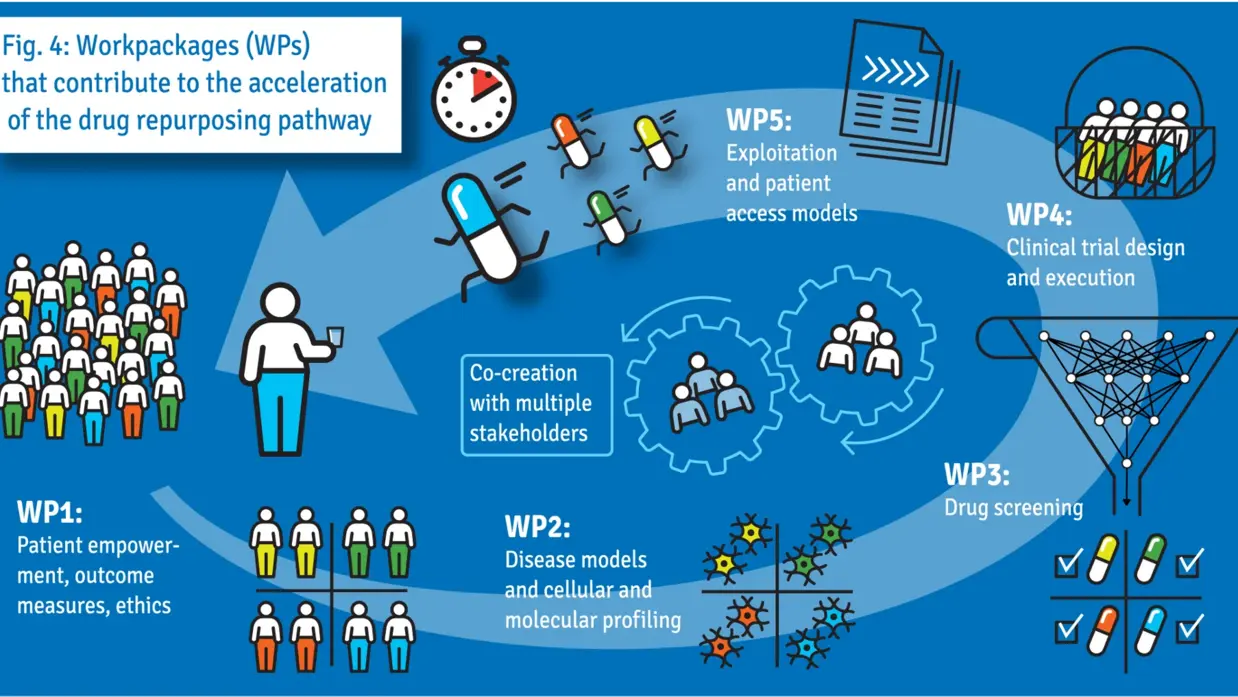
8,8 Millionen Euro für beschleunigtes Repurposing von Medikamenten für seltene neurologische Erkrankungen
SIMPATHIC-Konsortium erhält Zuschuss von der Europäischen Kommission
Das SIMPATHIC-Konsortium unter der Leitung des niederländischen Radboud University Medical Center und des Amsterdam University Medical Centers hat einen neuen Ansatz entwickelt, um den Einsatz vorhandener Medikamente für Patientengruppen mit seltenen neurologischen Erkrankungen zu beschleunigen. Das Konsortium hat einen Zuschuss von 8,8 Millionen Euro aus dem Programm Horizon Europe erhalten, um diese innovative Methode weiterzuentwickeln. Traditionell werden Medikamente für jede Krankheit einzeln entwickelt, was kostspielig und zeitaufwändig ist. Oft dauert es sehr lange, bis Patienten ein neues Medikament nutzen können. Das internationale SIMPATHIC-Konsortium, dem 22 internationale Partner angehören, hat eine neuartige Methode entwickelt, um den Einsatz bestehender Arzneimittel für andere Krankheiten zu beschleunigen, die auf dem Screening von Geweben einzelner Patienten beruht. Der Ansatz des Konsortiums wurde von der Europäischen Kommission anerkannt und mit einem Zuschuss von 8,8 Millionen Euro gefördert. Die Forscher werden eine neue Technologie einsetzen, um die Wirksamkeit bestehender Medikamente bei Patienten mit neurologischen Erkrankungen zu testen, wobei nur ein Röhrchen Blut oder ein kleines Stück Haut des Patienten benötigt wird. Diese Materialien enthalten Stammzellen, die die Forscher zu Nervenzellen züchten. Anschließend testen sie, wie diese auf eine Reihe vorhandener Medikamente reagieren. Wenn die Forscher eine positive Wirkung eines Medikaments feststellen, starten sie eine klinische Studie an einer Gruppe von Patienten mit unterschiedlichen Erkrankungen, aber ähnlichen klinischen Symptomen. Da die vorhandenen Medikamente bereits am Menschen getestet wurden, kann auf Tierversuche verzichtet werden, was den Einsatz von Medikamenten in neuen Anwendungen erheblich beschleunigt und die Forschungskosten senkt. Projektleiter und Bioinformatiker Prof. Peter-Bram 't Hoen von der Radboudumc erklärt: "Das Projekt wird die Effizienz und Geschwindigkeit der Entdeckung, Bewertung und Zulassung neuer Anwendungen für bestehende Medikamente erheblich verbessern." Die Projektleiterin und Kinderärztin und biochemische Genetikerin Prof. Clara van Karnebeek vom Amsterdam UMC fügt hinzu: “Darüber hinaus wird es enorme Auswirkungen auf die Versorgung von Patienten mit seltenen neurologischen Erkrankungen haben, zum Beispiel durch eine schnellere Verfügbarkeit von Medikamenten für diese schwächenden Krankheiten.”
Dem SIMPATHIC-Konsortium gehören 22 Partner an, darunter Forschungsteams von Radboudumc, Amsterdam UMC und anderen akademischen Zentren in Europa und Kanada, europäische Patientenorganisationen, Unternehmen und ein europäisches Infrastrukturnetz. Es wird erwartet, dass der innovative Ansatz des Konsortiums die Arzneimittelentwicklung revolutionieren wird.
Die Deutsche Heredo-Ataxie-Gesellschaft ist über Ihre Mitgliedschaft über die Eurotaxia an diesem Projekt im Rahmen der Patientenvertretung beteiligt.
Für ergänzende Fragen wenden Sie sich gerne an Herrn Andreas Nadke unter andreas.nadke@web.de
Das TREAT-ARCA-Projekt, das im Juni 2021 begann, ist ein präklinisches Forschungsprojekt, das sich auf zwei seltene Ataxien konzentriert: Autosomal rezessive spastische Ataxie von Charlevoix-Saguenay (ARSACS) und COQ8A-Ataxie (auch bekannt als Autosomal Rezessive Cerebellare Ataxie Typ 2, ARCA2). Dieses dreijährige Projekt wurde durch das EU-Forschungs- und Innovationsprogramm "Horizont 2020" gefördert.
Das Projekt
Rezessive Ataxien, zu denen beispielsweise ARSACS und COQ8A-Ataxie gehören, werden vererbt, wenn eine Person eine fehlerhafte Kopie des Gens von beiden Elternteilen erhält (die Eltern haben keine Symptome). Die Symptome, wie Gleichgewichtsstörungen, Koordinationsprobleme und undeutliches Sprechen, werden durch eine fortschreitende Degeneration des Kleinhirns verursacht, das an der Bewegungskoordination beteiligt ist. Derzeit gibt es keine krankheitsverändernden Behandlungen für eine der Ataxien.
Mit dem TREAT-ARCA-Projekt werden vier Ziele verfolgt:
- Erprobung von zwei vielversprechenden, neu entwickelten Medikamenten in Mausmodellen für ARSACS und COQ8A-Ataxie. Bei diesen Medikamenten handelt es sich um solche, die bereits für eine andere Erkrankung zugelassen sind, wodurch sich die Entwicklungszeit verkürzen kann, da bereits klinische Studien durchgeführt wurden und das Medikament bereits im Einsatz ist.
- Testen neuer Medikamente für ARSACS in einem Mausmodell. Neue potenzielle Behandlungsmöglichkeiten für ARSACS wurden bereits in früheren Arbeiten identifiziert.
- Test der Gentherapie für COQ8A-Ataxie in einem Mausmodell. Die COQ8A-Ataxie wird durch eine Mutation in dem Gen verursacht, das für das COQ8A-Protein kodiert, und könnte möglicherweise durch die Einführung der nicht mutierten Version des Gens in das zentrale Nervensystem korrigiert werden.
- Identifizierung und Validierung von Biomarkern. Bei der Vorbereitung künftiger klinischer Ataxie-Studien ist es von entscheidender Bedeutung, dass die Neurologen eine Möglichkeit haben, zu messen, ob die Behandlung anschlägt. Dies wird durch die Identifizierung von Biomarkern erreicht. Wenn es nicht gelingt, einen guten Biomarker zu identifizieren, kann dies sogar die Ursache für eine gescheiterte klinische Studie sein.